作为一种常见的血液系统恶性肿瘤,多发性骨髓瘤(MM)尚无法治愈,常用治疗手段包括放化疗、免疫调节剂(IMiDs)以及蛋白酶体抑制剂(PIs)等。
近年来,CD38单克隆抗体(Daratumumab,Isatuximab)的应用大大改善了MM患者生存状况,为MM的治疗带来了新的突破。然而,该类药物在治疗期间出现了不完全反应和靶向/非靶向效应[1,2],部分MM患者依然出现预后较差、脱靶毒性和耐药复发等情况。因此,优效、低毒的新型药物是当前MM及其他血液肿瘤所面临的迫切需求。
为解决此未被满足的临床需求,非同生物开发出一种新型人源化CD38单克隆抗体——FTL004,具有不与人红细胞结合和更高效促细胞凋亡活性的减毒增效优势,是治疗MM和非霍奇金淋巴瘤(NHL)等血液肿瘤的新型候选药物。
非同生物与四川大学生物治疗国家重点实验室合作开展了FTL004的作用机理研究,近日成果发表在国际权威期刊Journal of Hematology&Oncology(血液与肿瘤学杂志)。四川大学在读博士研究生张广兵博士为该文第一作者,四川大学杨金亮教授及非同生物黄莺博士、马梵辛博士为共同通讯作者。

图1:论文首页截图
接下来,就让我们来看看非同生物与四川大学的科学家联合团队是如何开展这项研究的。
首先,研究人员通过Biacore、ELISA、流式细胞术等研究方法,测试了FTL004与CD38蛋白、CD38+肿瘤细胞、免疫细胞以及人红细胞的结合情况。
结果显示,与Daratumumab或Isatuximab相比,FTL004对CD38蛋白及CD38阳性肿瘤细胞系表现出相似的亲和力,且与外周血单核细胞(PBMC)的大多数亚群细胞结合。
有趣的是,Daratumumab和Isatuximab均与人红细胞有较强的结合,且在间接抗球蛋白试验(IAT)中对红细胞有强烈的凝集和裂解作用;而FTL004则几乎不结合(图2)。在Daratumumab和Isatuximab的临床应用中,与红细胞的结合不但会导致红细胞凝集、裂解、antigen sink以至严重贫血等不良反应,而且会大量消耗抗体本身,影响药效[3,4]。FTL004则可避免这一情况发生,具有更优的药代动力学和安全性特征。

图2:与同类产品相比,FTL004与人红细胞不结合
接着,研究人员使用冷冻电镜(Cryo-EM)技术解析了FTL004与CD38结合的蛋白结构(图3)。FTL004与CD38的两个结合表位中心:其中一个与Isatuximab的表位部分重叠,而另一个则是独特的结合表位。

图3: FTL004与CD38的独特结合谱
然后,研究人员在抗肿瘤活性方面开展工作。结果显示,在不依赖Fc受体交联情况下,FTL004对淋巴瘤和MM细胞系以及MM患者原代骨髓瘤细胞具有更强的诱导凋亡能力。例如,FTL004诱导RPMI8226细胞的凋亡率为55%,而Isatuximab处理组为20%(图4)。
另外,为了提高对人Fcγ受体的亲和力,从而增强抗体依赖性细胞毒性(ADCC)[5],研究人员对FTL004的Fc结构域进行了工程化(S240D/I333E突变)改造。
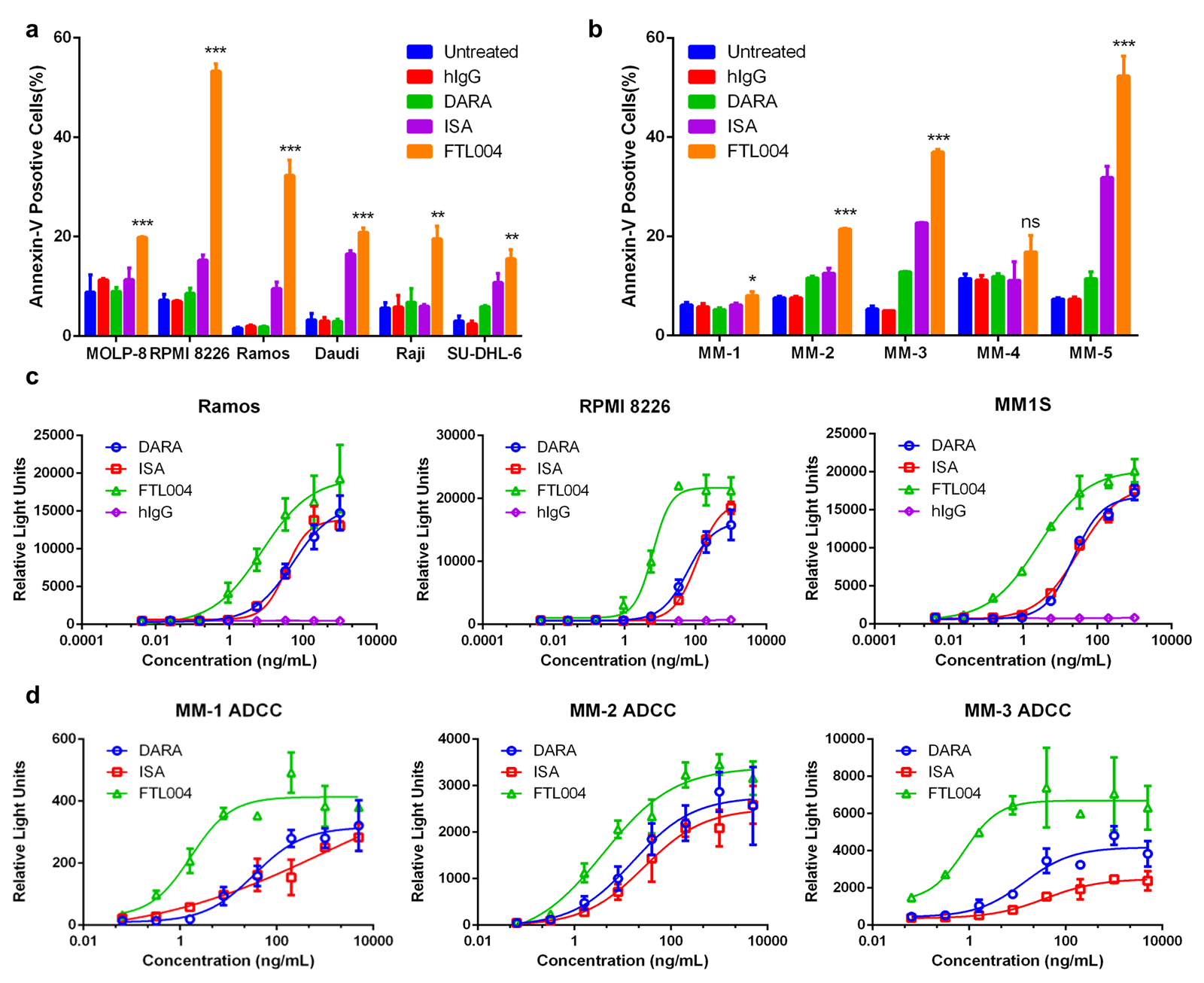
图4:FTL004的抗肿瘤功效
研究人员再进一步使用健康人PBMC检测了FTL004的ADCC、ADCP以及CDC活性。结果显示,FTL004表现出增强的ADCC活性,比Daratumumab高3倍(图5e);并且有较强的ADCP活性,诱导了74%的CD38+细胞吞噬(图5f);同时,CDC作用则低于Daratumumab(图5g),可进一步降低CDC引起的输注反应。
最后,研究人员在不同的淋巴瘤荷瘤小鼠中进行了体内药效学研究。结果显示,与对照组相比,FTL004可显著抑制肿瘤生长(图5h)。
体外和体内研究结果均表明,FTL004具有高效的抗肿瘤活性。
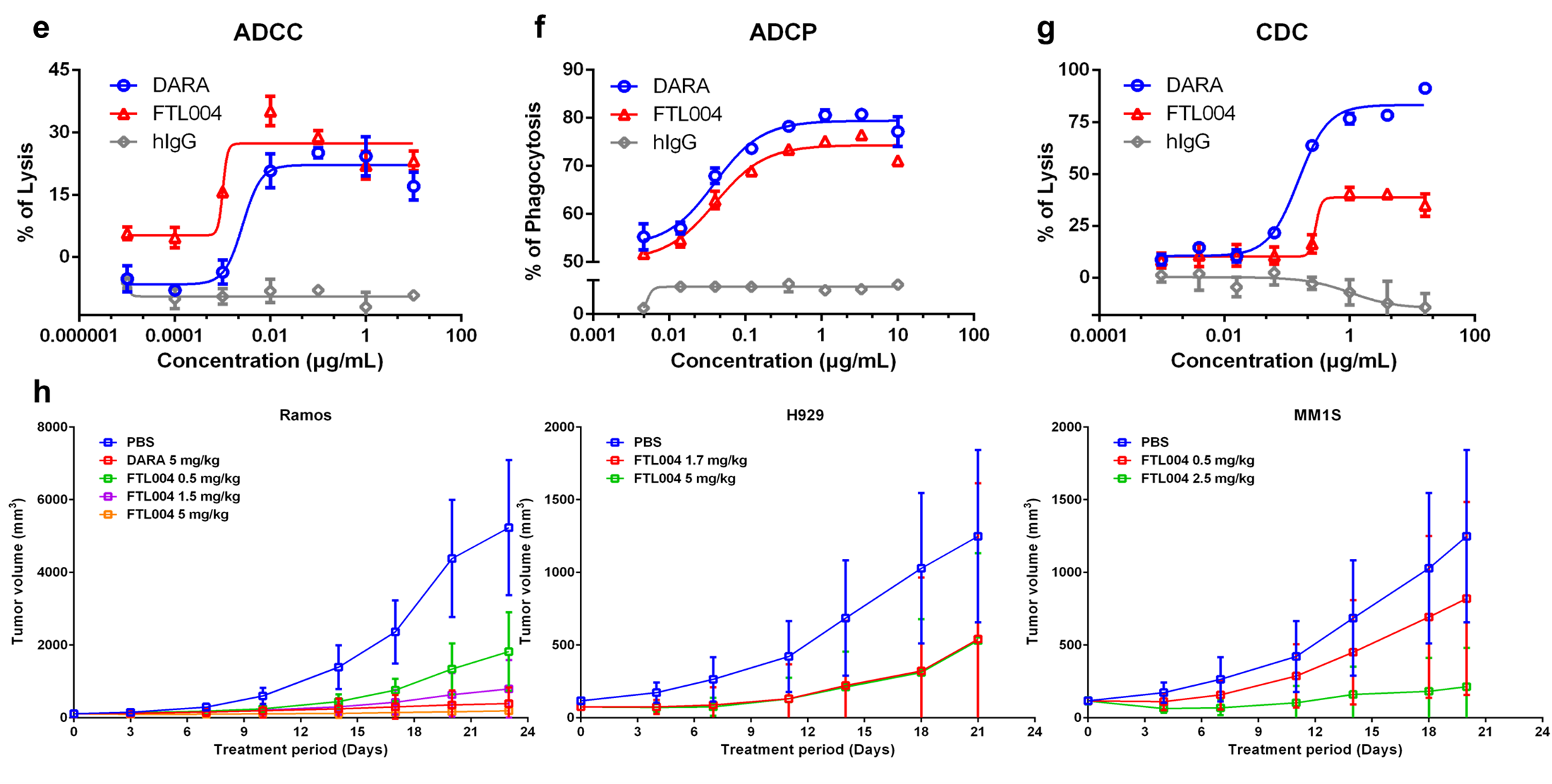
图5:FTL004的抗肿瘤功效
综上,此项研究结果表明,FTL004是一种具有高度差异化的新型CD38治疗性单抗。它的抗原结合表位与Daratumumab和Isatuximab均不同,对于肿瘤细胞的杀伤作用除了具备Daratumumab的ADCC和ADCP之外,也具备优于Isatuximab特有的直接诱导凋亡作用。此外,FTL004是目前全球唯一一种与人红细胞无结合的CD38抗体,可避免同类产品给药过程中产生的红细胞凝集、裂解、antigen sink等输注反应,具备更好的治疗效果和安全性特征。
FTL004已于2022年10 月获得美国FDA的临床试验许可。减毒增效的高度差异化优势使其有望成为best-in-class,并有望在更广泛的治疗领域,如实体瘤和自身免疫病方面得以应用。
参考文献:
1. Bhatnagar V, Gormley NJ, Lola L, et al. FDA Approval Summary: Daratumumab for Treatment of Multiple Myeloma After One Prior Therapy. Oncologist. 2017.
2. Ofran Y. Daratumumab: new indications revolving around "off-targets". Haematologica. 2021;106(12):3032-3.
3. Werle E, Ziebart J, Wasmund E, Eske-Pogodda K. Daratumumab Interference in Pretransfusion Testing Is Overcome by Addition of Daratumumab Fab Fragments to Patients' Plasma. Transfusion Medicine and Hemotherapy. 2019:1-8.
4. Lancman G, Arinsburg S, Jhang J, Cho HJ, Jagannath S, Madduri D, et al. Blood Transfusion Management for Patients Treated With Anti-CD38 Monoclonal Antibodies. Front Immunol. 2018;9:2616.
5. Jebamani P, Sriramulu DK, Jung ST, Lee S-G. Structural Study on the Impact of S239D/I332E Mutations in the Binding of Fc and FcγRIIIa. Biotechnology and Bioprocess Engineering. 2021;26(6):985-92.






